一、总体要求
1.伦理委员会接待时间:每周二、周三下午14:00-17:00。
2.伦理委员会办公室地址:襄阳市中心医院东津院区门诊4楼9区4902。
3.伦理委员会联系电话:0710-3511354。
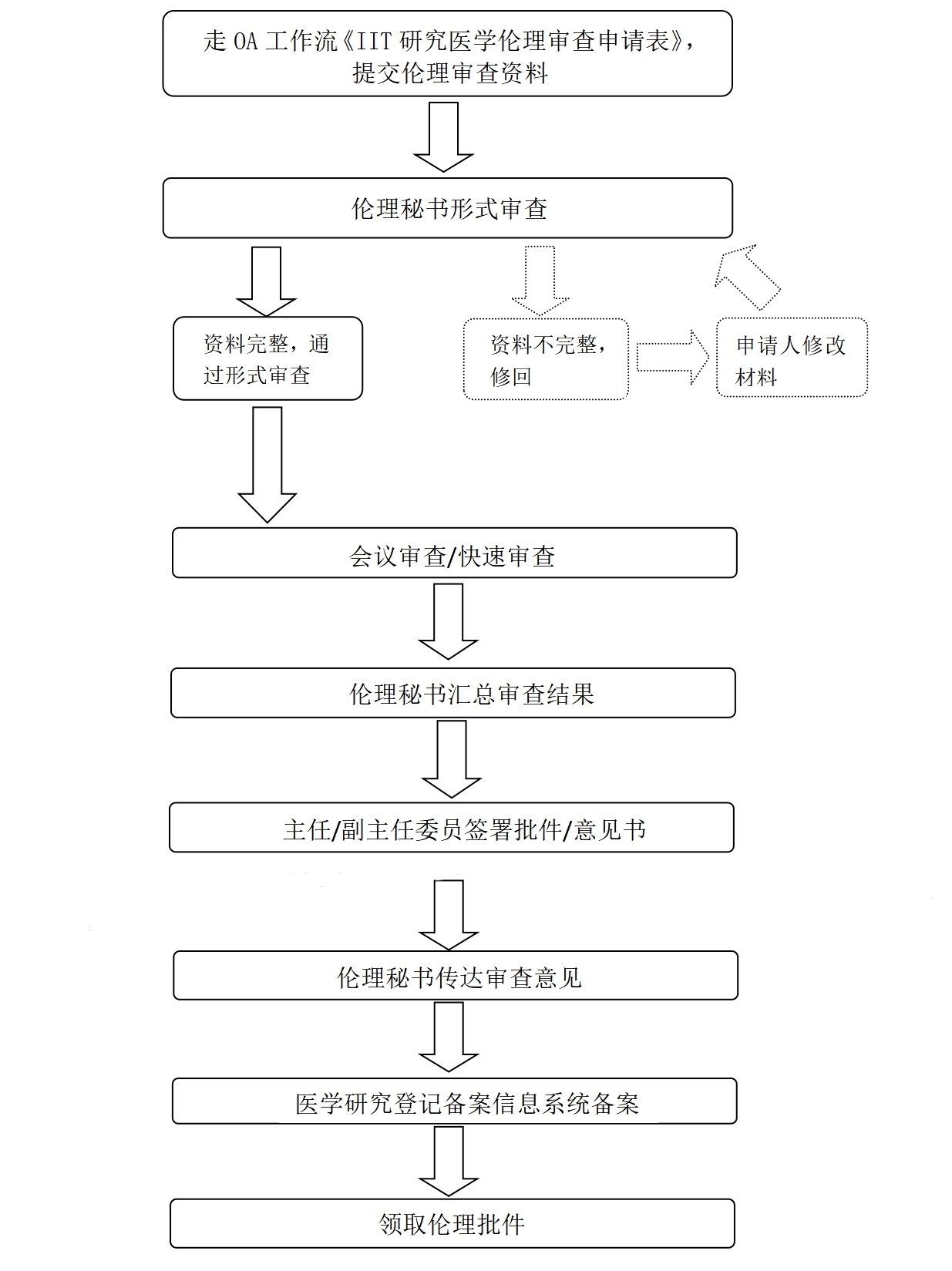
4.伦理申请总体流程:走OA工作流《IIT研究医学伦理审查申请表》 → 线上审核通过后,递交纸质材料(A4纸双面打印)到伦理办公室 → 同步进入医学研究登记备案信息系统(https://www.medicalresearch.org.cn/login)备案(首次备案需联系伦理秘书进行授权) → 备案完成后,领取伦理批件。
5.伦理审查费支付账号:
账户名称:襄阳市中心医院
开户行:工行襄阳荆州街支行
账号:1804 0011 2904 4004 092
伦理审查费缴纳范围:有公司资助的临床研究的会议审查、年度跟踪审查。
伦理审查费缴纳时限:审查前3天,且需于每月1-25号打款,不允许月底打款。打款后自行填写并发送收款通知书(附件1)至伦理群。
电子发票需于通知后尽快领取,逾期不予办理。
二、会议审查
1.会议审查频率:1次/月。
2.受理范围:①干预性研究;②快速审查后主审委员建议转为会议审查的项目;③其他风险较大的研究。
3.伦理审查材料:
1)医学伦理申请一览表;
2)医学伦理审查申请表;
3)组长单位伦理批件(如有);
4)项目经费来源说明;
5)主要研究者简历;
6)试验研究方案(注明版本号/版本日期);
7)知情同意书(注明版本号/版本日期);
8)研究者手册(如有,注明版本号/版本日期);
9)病例报告表(如有,注明版本号/版本日期);
10)招募广告(如有,注明版本号/版本日期);
11)保险单据(如有)
相关模板详见OA工作流《IIT研究医学伦理审查申请表》附件1,递交纸质版材料时需将审批完成的工作流一同交过来。
4.上会准备材料要求如下:
★★上会材料清单:
1)PPT(模板详见OA工作流《IIT研究医学伦理审查申请表》附件2);
2)组长单位伦理批件(如有);
3)试验研究方案(注明版本号/版本日期);
4)知情同意书(注明版本号/版本日期)和其他提供给受试者的书面材料;
5)要求:A4纸双面打印,订书机装订;
6)具体打印份数会前由伦理秘书通知。
★★知情相关:
1)我院审查科研项目的伦理委员会全称为:襄阳市中心医院医学伦理委员会,联系电话:0710-3511354,联系地址:襄阳市东津新区鹿门大道5号襄阳市中心医院东津院区。
2)根据《药物临床试验质量管理规范》(2020年)第二章第九条关于受试者的定义,核查全文,将限定参与临床研究的“患者”称谓根据文中的情景内容替换为“受试者”或“您”等称谓。
3)关于受试者补偿:对于有干预、风险大的研究,研究者需要给予受试者风险相当的补偿。
4)研究相关损害的补偿与赔偿,根据2020年版《药物临床试验质量管理规范》第三十九条:申办者应当承担受试者与临床试验相关的损害或者死亡的诊疗费用,以及相应的补偿。申办者和研究者应当及时兑付给予受试者的补偿或者赔偿。研究者和申办方的赔偿责任可通过合同规定,知情中受试者只需要被告知何种情况可以得到赔偿。注意:不要有“医疗事故除外”等表述,若有,建议删除。医疗事故是在行政管理和处罚中使用的,司法系统现在统一使用医疗损害责任纠纷。
5)采血点及采血量应在知情同意书中说明。
6)英文缩写首次出现应有中文标注。
7)签名页中:对于无民事行为能力或部分民事行为能力的受试者,需监护人签字。
8)不能将免费用药作为获益内容。
9)涉及患者隐私提供给第三方(向人类遗传资源办公室提出申请标本外送时、保险赔偿流程执行时),需要补充操作流程、保密声明等资料供伦理审查。
10)受试者的血液及组织标本均需外送,需要提供外送检测单位的资质证明及保密协议。知情同意书中需告知外送哪家实验室进行检测,检测后样本的处理。
11)避免出现“撤回知情同意书”,可以用“退出研究”代替。
12)知情同意书需通俗易懂。
★★招募广告要求:
1)信息完整,写明研究目的、研究介绍等;
2)避免出现诱导性语言。
★★PPT要求:
1)使用我院统一模板(模板详见OA工作流《IIT研究医学伦理审查申请表》附件2);
2)内容与递交的伦理材料保持一致,同步、及时更新。
★★其他:
1)伦理审核材料要求提供全部组长单位批件,包括审核未通过的相关意见。
2)涉及其他科室的试验,研究团队中需有一名该相关医学背景医生。如涉及中医的试验,研究团队中需有一名中医背景医生。
5.伦理会决定传达:
1)同意:出《伦理批件》,伦理会后请准备电子版《伦理会议记录》、《药物临床试验伦理委员会会议审查批件》、会议照片、会议录音打包发送至伦理秘书的OA邮箱。
2)修改后批准/修改后再审:出《伦理审查意见》,伦理会后请准备电子版《伦理会议记录》、《伦理审查意见》、会议照片、会议录音打包发送至伦理秘书的OA邮箱,根据伦理意见对项目进行修正及说明,进入复审审查程序(具体流程见“四、复审审查”)。
三、快速审查
1.快速审查频率:随时受理。
2.受理范围:①观察性研究;②心理干预性研究;③回顾性研究;④调查问卷、个案报道、利用数据库等进行的其他风险较小的研究。
3.伦理审查材料:
1)医学伦理申请一览表;
2)医学伦理审查申请表;
3)组长单位伦理批件(如有);
4)项目经费来源说明;
5)主要研究者简历;
6)试验研究方案(注明版本号/版本日期);
7)知情同意书(注明版本号/版本日期);
8)研究者手册(如有,注明版本号/版本日期);
9)病例报告表(如有,注明版本号/版本日期);
10)招募广告(如有,注明版本号/版本日期);
11)保险单据(如有)
相关模板详见OA工作流《IIT研究医学伦理审查申请表》附件1,递交纸质版材料时需将审批完成的工作流一同交过来。
4.伦理会决定传达:
1)同意:出《伦理批件》。
2)转为会议审查:参照“二、会议审查”。
四、复审审查
1.根据伦理意见复审:伦理审查结果为“修改后批准”复审审查方式选择快速审查,伦理审查结果为“修改后再审”复审审查方式选择会议审查。
2.递交电子版资料,包括递交信、《复审申请表》(1 份)、《复审工作表》(2 份)、批件复审资料清单(含版本号)和复审资料,发送至伦理秘书的OA邮箱进行形式审查。电子版资料要求:需要研究者签字的文件需上传签字后扫描件,其余电子文件以盖章后的PDF格式为准。
3.电子资料形式审查通过后,递交伦理审查纸质版资料。
4.材料形式审查常见问题:
1)需提供修正的对比清单和修正后的内容及相关资料,有版本号、版本日期的文件务必确保与清单中所列的版本号/日期保持一致。
2)修正情况一览表要求如下:(1)要素包括修正材料名称和具体页码、修正前内容、修正后内容、修正原因;(2)修改对比文件中需体现修改痕迹,删除的内容用删除线标注或特殊颜色标注,增加的内容用下划线标注或特殊颜色标注。
3)复审审查时需对伦理委员会的意见逐条回复并/或提交修改后文件,如伦理意见不涉及的文件,无需再次递交,例如仅对知情同意书提出伦理修改意见,未对研究方案提出伦理修改意见,则无需再提交研究方案。
附件1:
收款通知书
财务处:
汇款单位名称于xxxx年xx月xx日汇入我院的一笔款项,金额为xxxx元(包含6%税费),此款系“项目名称”伦理初审/年度跟踪审查费,请将该笔款项计入GCP伦理审查费专账,并予以开增值税专用/普通(二选一)发票。
发票信息 | |
名称 | |
纳税人识别号 | |
地址、电话 | |
开户行 | |
账号 | |
经办人: 经办人手机号:
襄阳市中心医院医学伦理委员会
xxxx年xx月xx日



