一、SUSAR的定义
可疑且非预期严重不良反应(suspected unexpected serious adverse reaction,SUSAR),是指同时满足相关、严重和非预期的不良事件。
二、SUSAR的三大特征
一)严重性(serious):严重性是GCP法规的定义,指在任何剂量下发生的不良医学事件:1)导致死亡;2)危及生命(指即刻存在死亡的风险,并非是指假设将来发展严重时可能出现死亡);3)导致住院或住院时间延长;4)永久或显著的残疾/功能丧失;5)先天性异常或出生缺陷;6)其他重要医学事件(可能不会立即死亡、危及生命或住院,但需要采取医学措施以预防上述情况的发生,例如超敏反应早期)。
二)非预期的(unexpected)
1. 定义:非预期是指以前未观察到,而不是根据药物的药理学特性来推测是否可能发生。比如,疫苗基本都有过敏、发热的可能,但不能在临床试验一开始就把过敏和发热作为已知的风险,而是要在临床试验中的确发生了,且发生了多例后做一个汇总分析,认为其是已知风险后,我们才能将其写入研究者手册(Investigator's brochure,IB)的安全参考信息(reference safety information,RSI)部分,作为预期的风险来识别。
2. 判定标准:临床试验中发生的不良事件(adverse event, AE ),预期性的判定要参考研究者手册中(IB)中的安全性参考信息(RSI)部分。(对已经上市的药品,其预期性的判定需要参考药品说明书中的不良反应、禁忌、注意事项等章节。)
术语 | 产品阶段 | 参考文件 |
预期/非预期 | 研发 | 研究者手册(IB)中的RSI |
已上市 | 说明书 |
注意:①如果一个AE和RSI中描述的一致,则被认为是预期的。
②如果一个AE其特异性、严重程度、后果、频率和RSI中所用的术语或描述不一致,则被认为是非预期的。
③如果不能确定一个AE是预期的还是非预期的,则该AE应按非预期处理。
RSI中列出的SAE | 个例报告中的可疑SAE | 因特异性和/或严重程度视为非预期 |
急性肾衰竭 | 间质性肾炎 | 特异性 |
肝炎 | 暴发性肝炎 | 严重程度 |
脑血管意外 | 脑血栓栓塞 | 特异性 |
剥脱性皮炎 | 史蒂文斯-约翰逊综合征 | 严重程度和特异性 |
肝脏功能检查值短暂升高 | 肝脏功能检查值升高持续数月 | 严重程度 |
高血压 | 高血压危象 | 严重程度 |
带状疱疹 | 多发性皮肤带状疱疹 | 严重程度 |
脓毒症 | 感染性休克 | 严重程度 |
室上性心律失常 | 房颤 | 特异性 |
三)相关性:即药物与不良事件至少存在合理的可能性,因果关系无法排除。申请人与研究者任何一方认为相关,即判定为相关。
许多词被用于描述药物与不良事件因果关系的程度,但目前尚无一个标准的国际规则。以下以五分法为例,列出相关性判定的一般方法。
时间相关性 | 是否已知 | 去激发 | 再激发 | 其他解释 | |
肯定有关 | + | + | + | + | - |
很可能有关 | + | + | + | ? | - |
可能有关 | + | ± | ±? | ? | ±? |
可能无关 | - | - | ±? | ? | ±? |
肯定无关 | - | - | - | - | + |
+表示肯定或阳性;-表示否定或阴性;±表示难以判断;?表示不明。
二、SUSAR举例
某受试者服用研究药物后出现高血压危象,并因此住院,研究者认为高血压危象与研究药物相关。那么这个事件是不是SUSAR呢?我们来看看是否同时满足严重性、相关性和非预期性。
严重性:满足。依据:住院
相关性:满足。依据:研究者判定为“相关”。
非预期性:满足。依据:翻看IB中的RSI,高血压虽然在RSI列表中,但高血压危象和高血压的描述显然不同,严重性明显增加。
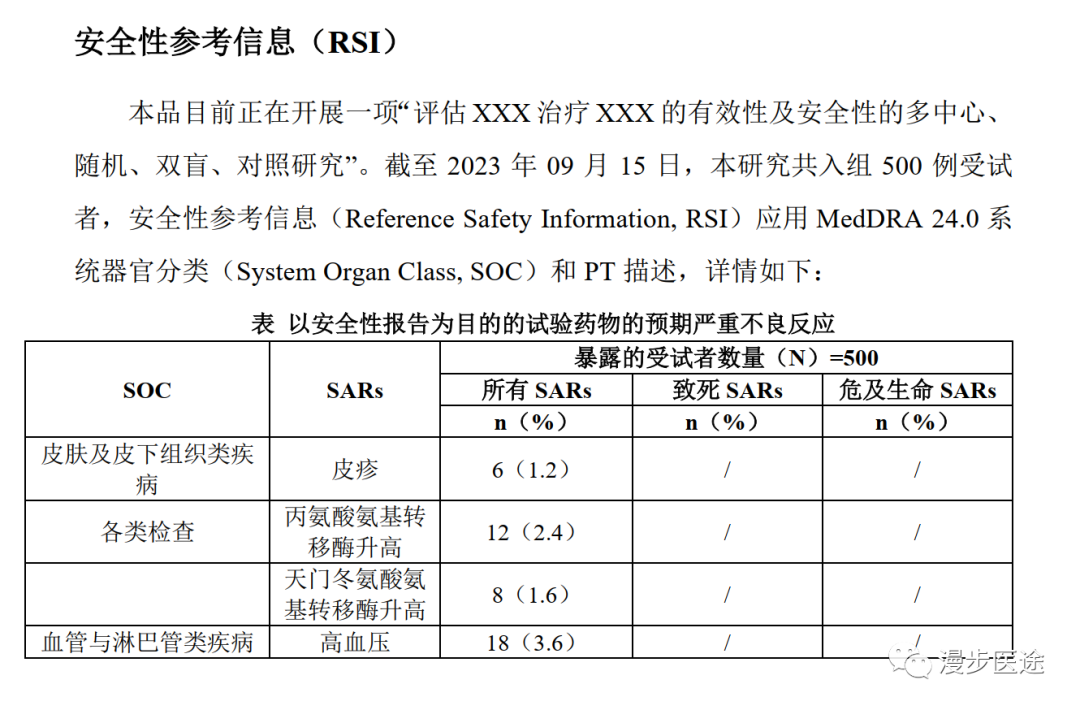
以健康受试者为对象的I期临床试验,研究者手册中往往没有RSI列表。这时,我们认为所有不良事件均为非预期。
在肿瘤I期临床试验中,IB中开始没有RSI,所有SAE应为非预期。随着SAE例数的增加,经过汇总分析后,认为某SAE是已知风险后,我们就可以将其写入IB的RSI部分,作为预期的风险来识别了。
参考文献:
1. 《E2A:临床安全性数据的管理:快速报告的定义和标准》
2.《研究者手册中安全性参考信息撰写技术指导原则》
GCP机构办 程瑾
2023年11月7日



